輔酶 Q0(牛樟芝的主要醌衍生物)透過人類黑色素細胞和角質形成細胞中的自噬誘導進行體外和體內脫色活性
摘要
圖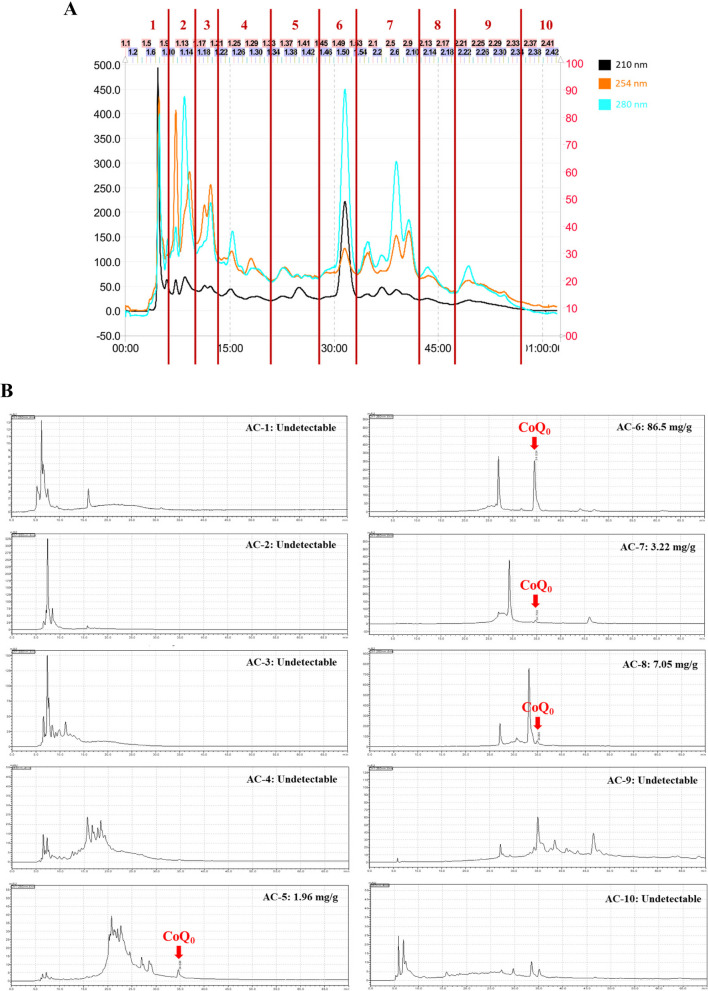
圖1
從牛樟芝分離CoQ 0…
圖1
透過MPLC 從牛樟芝分離CoQ 0 與高效液相色譜分析。 A 牛樟芝…
圖 1 以 MPLC 和 HPLC 分析從牛樟芝中分離 CoQ0。 A採用RP-18 MPLC玻璃柱,以水和甲醇為流動相洗脫樟芝。 B 使用 RP-C18 HPLC 管柱確定了 10 個級分(AC-1 至 AC-10)。透過稀釋儲備液製備一系列標準溶液 (CoQ0),並利用它們計算 AC-1 至 AC-10 級分的 CoQ0 濃度。最終的 CoQ0 產物溶解在 0.1% DMSO 中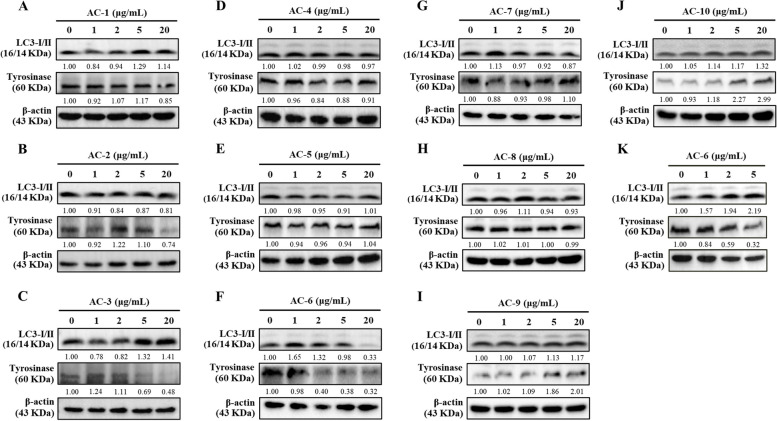
2
2 p>AC-6 上調LC3-I/II 並抑制…
圖2
AC-6 上調LC3-I/II 並抑制酪胺酸酶表現在黑色素瘤B16F10 細胞中。 A-K B16F10…
圖2 AC-6在黑色素瘤B16F10細胞中上調LC3-I/II並抑制酪胺酸酶表現。 A-K B16F10細胞以AC-1至AC-10 (0-20 μg/mL)或AC-6 (0-5 μg/mL)處理24小時。以免疫印跡評估LC3-I/II 和酪胺酸酶的表達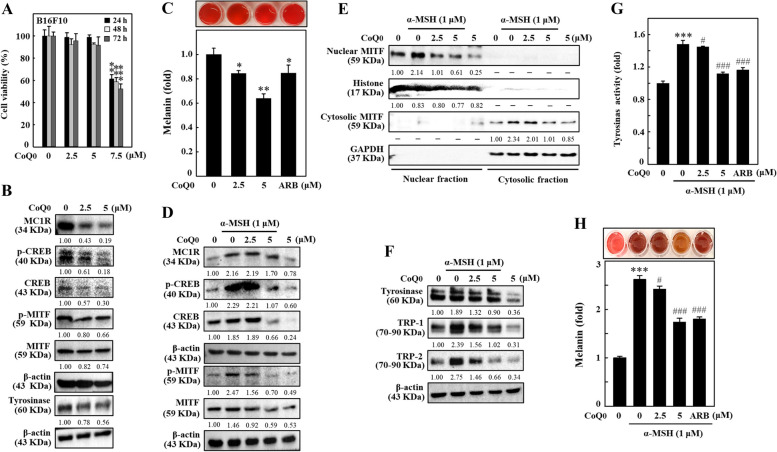 < p> 圖3
< p> 圖3 CoQ 0 抑制…中的黑素生成
圖3
CoQ 0 抑制α-MSH 刺激的B16F10 細胞中的黑素生成。 A 細胞與...一起孵育
圖 3 CoQ0 抑制 α-MSH 刺激的 B16F10 細胞中的黑素生成。 A 將細胞與 CoQ0 (0-7.5 μM) 一起孵育 24、48 或 72 小時,並進行 MTT 測定以確定細胞活力。 B 細胞以CoQ0 (0-5 μM) 處理指定的持續時間,並檢測MC1R (5 分鐘)、p-CREB (1.5 小時)、CREB (1.5 小時)、p -使用免疫印跡法測量 MITF(4 小時)、MITF(4 小時)和酪胺酸酶(24 小時)。 C 細胞以 CoQ0(0-5 μM,72 小時)處理,並依方法部分所述測定黑色素形成。 D、F 先以 CoQ0 (0-5 μM) 處理細胞,然後以 α-MSH (1 μM) 刺激指定的測量時間(D) MC1R (5 分鐘)、p-CREB (1.5 小時)、CREB (1.5 小時)、p-MITF (4 小時) 和MITF (4 小時) 水準; (E) 細胞核和細胞質 MITF(4 小時)水準;使用免疫印跡法檢測 (F) 酪胺酸酶(24 小時)、TRP-1(24 小時)和 TRP-2(24 小時)濃度。 24小時後測定G、H酪胺酸酶活性,72小時後測定黑色素水平,如方法部分所述。熊果素(ARB,200 μM)作為陽性對照。結果為平均值±SD (n=3)。 *p< 0.05; **p< 0.01; ***p <與未處理的細胞相比為 0.001。 #p < 0.05; ###p <與CoQ0 處理的細胞相比,為0.001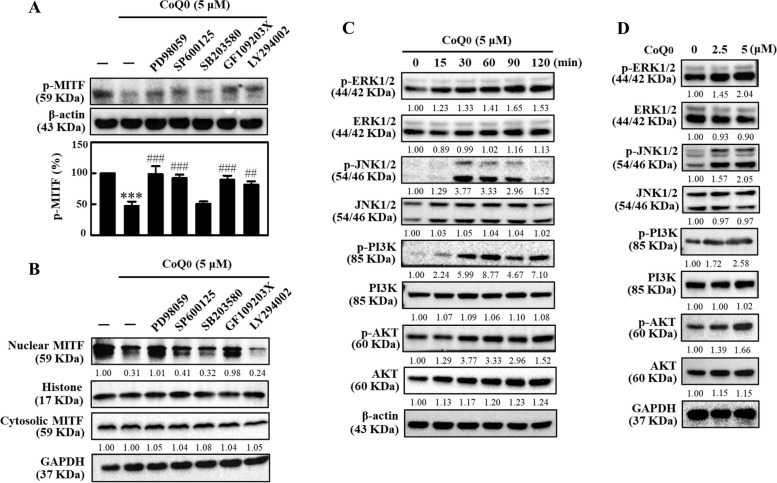
圖4 < / p>
CoQ 0 抑制MITF 核...
圖4
CoQ 0 透過ERK、JNK、... 抑制B16F10 細胞中的MITF 核轉位< /p> 圖 4 4 CoQ0 透過 ERK、JNK 和 PI3K/AKT 訊息傳遞路徑抑制 B16F10 細胞中的 MITF 核轉位。 A、B 先用 ERK (PD98059, 30 μM)、JNK (SP600125, 25 μM)、p38 (SB203580, 20 μM)、PKC ( GF109203X,2.5 μM)或PI3K/AKT(LY294002,30 μM)1 小時,然後加入CoQ0(5 μM,4 小時)。使用免疫印跡法測定 p-MITF 和核/胞質 MITF 的含量。 C 細胞以 CoQ0(5 μM,0-120 分鐘)處理。進行免疫印跡測定以確定 p-ERK1/2、ERK1/2、p-JNK1/2、JNK1/2、p-PI3K、PI3K、p-AKT 和 AKT 蛋白的含量。 D 細胞以 CoQ0 (0-5 μM) 處理指定時間,並進行免疫印跡以確定 p-ERK1/2 (90 分鐘)、ERK1/2 (90 分鐘) 的水平)、p- JNK1/2(30 分鐘)、JNK1/2(30 分鐘)、p-PI3K(60 分鐘)、PI3K(60 分鐘)、p-AKT(60 分鐘)和AKT(60 分鐘)蛋白。結果為平均值±SD (n=3)。 ***p <與未處理的細胞相比為 0.001。 ###p <與CoQ0 處理的細胞相比,為0.001 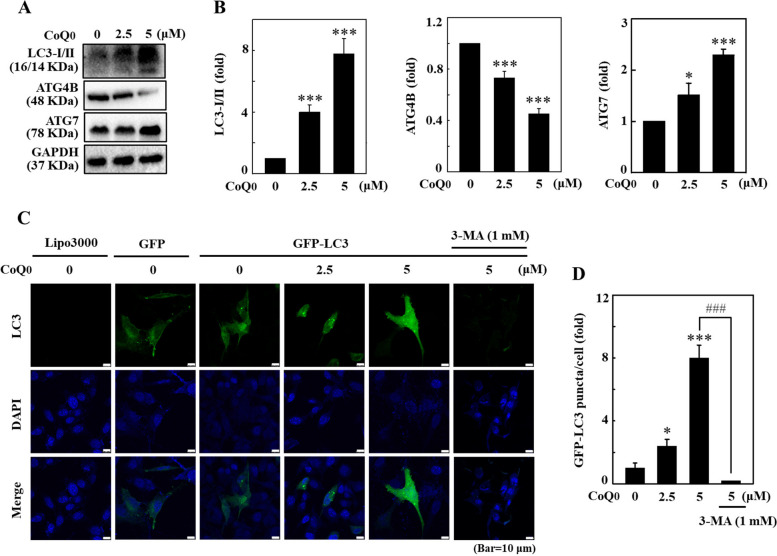
圖5 < / p>
CoQ 0 誘導自噬流…
圖 5
CoQ 0 在 B16F10 細胞誘導自噬流。 A , B 細胞是…
圖 5 CoQ0 在 B16F10 細胞中誘導自噬流。 A、B 細胞以 CoQ0(0-5 μM,24 小時)處理。孵育後,對細胞進行免疫印跡測定以確定 LC3-I/II、ATG4B 和 ATG7 蛋白質水平。 C, D 將 GFP-LC3 表現載體轉染至細胞中,然後以 CoQ0(0-5 μM,24 h)處理。使用共聚焦顯微鏡觀察 CoQ0 誘導的 GFP-LC3 斑點。形成 GFP-LC3 斑點的細胞的定量以直方圖形式呈現。結果為平均值±SD (n=3)。 *p< 0.05; ***p <與未處理的細胞相比為 0.001。 ###p <與CoQ0 處理的細胞相比,為0.001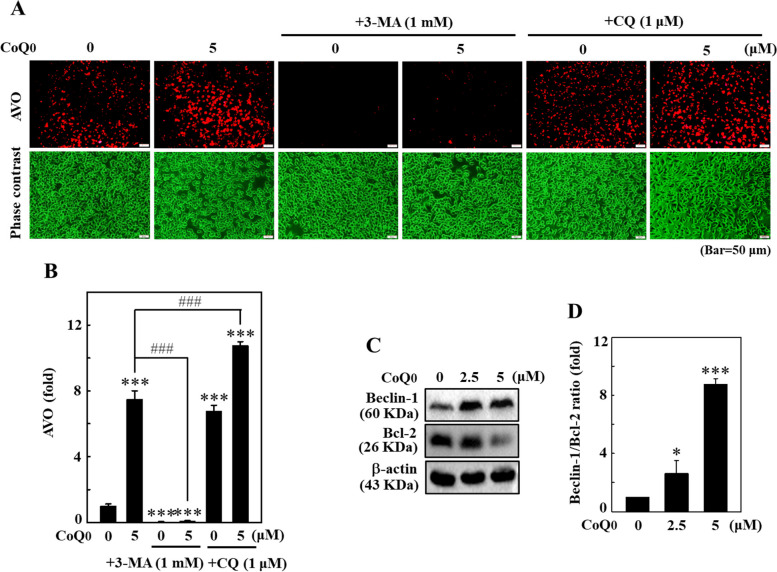
圖6 < / p>
CoQ 0 增加AVO 形成...
圖6
CoQ 0 增加AVO 形成並失調B16F10 細胞中Beclin-1/Bcl-2 的比例。 ... < /p> 圖 6 CoQ0 增加 B16F10 細胞中 AVO 的形成並失調 Beclin-1/Bcl-2 比例。 A、B 細胞先用3-MA(1 mM,1 小時)或CQ(1 μM,1 小時)處理,再用CoQ0(0 或5 μM)處理,24 小時)。使用螢光顯微鏡觀察細胞內 AVO 的形成(在紅色濾光片下)。紅色螢光的強度與 AVO 數成正比。 C、D 細胞以 CoQ0(0-5 μM,24 小時)處理。進行免疫印跡測定以確定Beclin-1和Bcl-2蛋白水平,數據以Beclin-1/Bcl-2的比率表示。結果為平均值±SD (n=3)。 *p< 0.05; ***p <與未處理的細胞相比為 0.001。 ###p <與CoQ0 處理的細胞相比,為0.001 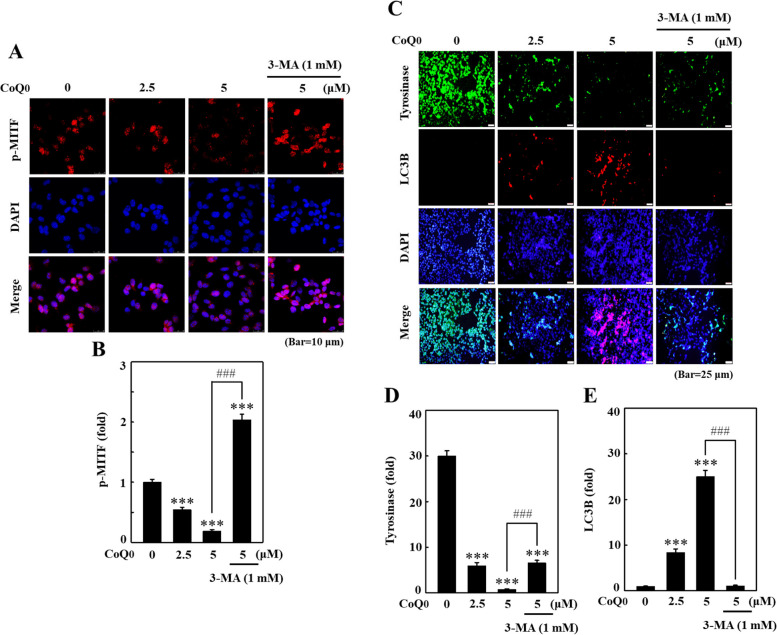
圖7 < / p>
CoQ 0 抑制 p-MITF 和…
圖 7
CoQ 0 透過 B16F10 細胞自噬抑制 p-MITF 和酪胺酸酶表現。細胞…
圖 7 CoQ0 在 B16F10 細胞中透過自噬抑制 p-MITF 和酪胺酸酶表現。用或不用3-MA(1 mM,1 小時)預處理細胞,然後用CoQ0 (0-5 μM) 預處理4 小時(A、B)或24 h(C,E)。治療結束時,測量p-MITF(A、B)、酪胺酸酶和LC3B(C、E)水平使用免疫螢光染色。結果為平均值±SD (n=3)。 ***p <與未處理的細胞相比為 0.001。 ###p <與CoQ0 處理的細胞相比,為0.001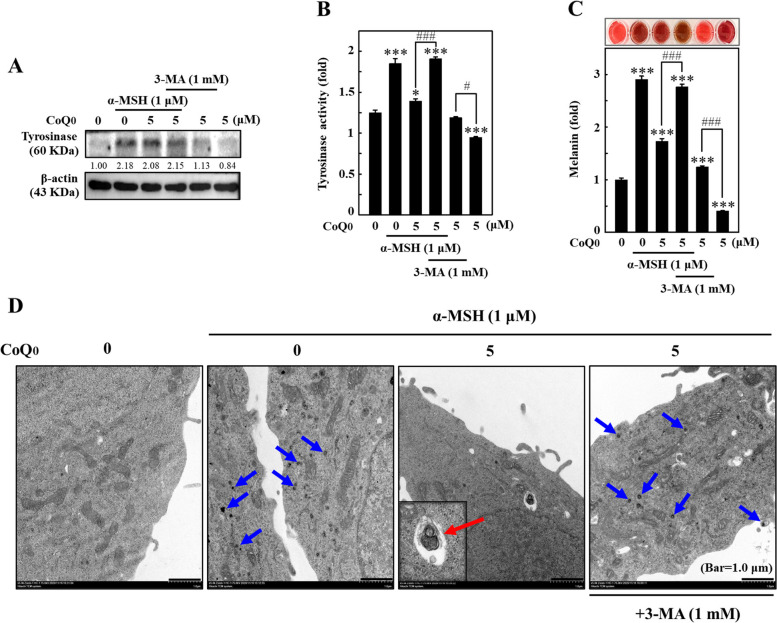
圖8 < / p>
CoQ 0 透過...抑制黑素生成
圖8
CoQ 0 透過在α-MSH 刺激的B16F10 細胞中誘導自噬作用來抑制黑素生成。 A-C 細胞…
圖8 CoQ0 透過誘導α-MSH 刺激的B16F10 細胞自噬作用來抑制黑素生成。 )處理)在不存在或存在3-MA(1 mM,1 小時)的情況下,然後用α-MSH (1 μM) 刺激24 小時(A、B)或 72 小時 (C)。 A 以免疫印跡法測定酪胺酸酶的表達。 B酪胺酸酶活性依照材料與方法所述進行測量。 C 量化細胞內黑色素水平。結果為平均值±SD (n=3)。 *p< 0.05; ***p <與未處理的細胞相比為 0.001。 #p < 0.05; ###p <與 CoQ0 處理的細胞相比為 0.001。 D 細胞用或不用 3-MA(1 mM,1 小時)處理,然後用 CoQ0(0 或 5 μM)處理並用 α-MSH(1 μM,24 小時)刺激。在 TEM 下觀察細胞內黑色素體吞噬自噬體。藍色和紅色箭頭分別表示吞噬黑素體的自噬體和自溶小體的形成。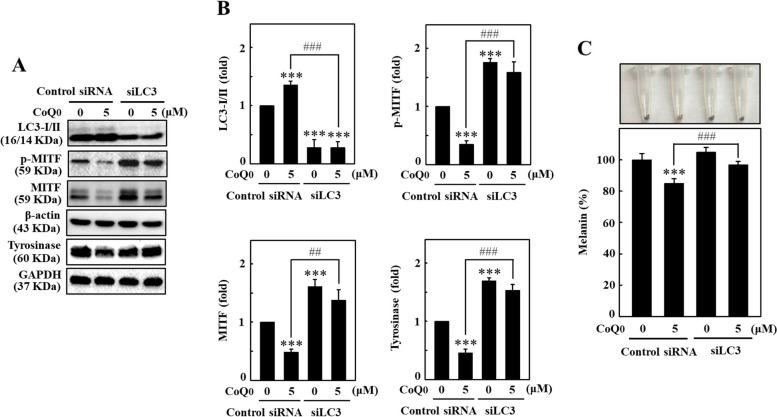
圖 9
抑制 LC3CoQ 0…
圖9
沉默LC3 減少了B16F10 細胞中CoQ 0 誘導的抗黑素生成。 A , B…
圖 9 沉默 LC3 可減少 B16F10 細胞中 CoQ0 誘導的抗黑素生成。 A、B 以 CoQ0(0 或 5 μM)處理對照 siRNA 和 siLC3 轉染的細胞指定的持續時間,以確定 LC3B 的水平(24 小時), p-MITF (4 h)、MITF (4 h) 和酪胺酸酶(24 h) 蛋白。經過各種處理後提取蛋白質並進行免疫印跡。 C 用CoQ0(0或5μM,24小時)處理轉染的B16F10細胞,然後測量細胞內黑色素含量。結果為平均值±SD (n=3)。 **p < 0.01; ***p <與未處理的 siRNA 轉染細胞相比,為 0.001。 ##p < 0.01; ###p <與 CoQ0 處理的 siRNA 轉染細胞相比,為 0.001。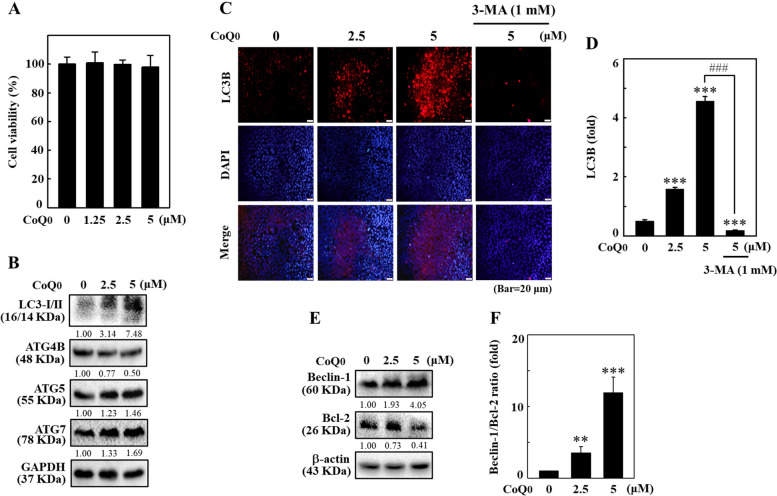
圖 10
CoQ 0自調節自調節自調整噬相關蛋白…
圖10
CoQ 0 在HaCaT 細胞中調控自噬相關蛋白。用 CoQ 處理細胞…
圖 10 HaCaT 細胞中 CoQ0 調控的自噬相關蛋白。用 CoQ0(0-5 μM,24 小時)處理細胞。 A 以MTT法檢測細胞活力。 B 對細胞進行免疫印跡以確定 LC3-I/II、ATG4B、ATG5 和 ATG7 蛋白質水平。 C、D 先用或不用 3-MA(1 mM,1 小時)處理細胞,然後用 CoQ0(0-5 μM,24 小時)處理。進行免疫螢光染色以確定LC3B水平。 E、F 細胞以 CoQ0(0-5 μM,24 小時)處理,然後進行免疫印跡以確定 Beclin-1 和 Bcl-2 蛋白質水平。數據以 Beclin-1/Bcl-2 比率表示。結果為平均值±SD (n=3)。 **p < 0.01; ***p <與未處理的細胞相比為 0.001。 ###p <與CoQ0 處理的細胞相比,為0.001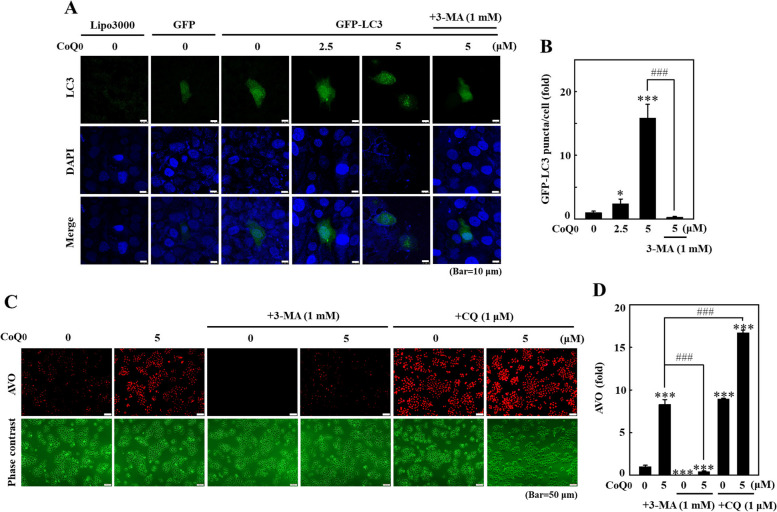
圖11 < / p>
CoQ 0 誘導自噬流…
圖 11
CoQ 0 在 HaCaT 細胞中誘導自噬流。首先用…處理細胞。首先用或不用 3-MA(1 mM,1 小時)和/或 CQ(1 μM,1 小時)處理細胞,然後用 CoQ0(0-5 μM,24 小時)處理。 A、B GFP-LC3表現載體轉染細胞,共聚焦顯微鏡下觀察CoQ0誘導GFP-LC3斑點的形成。 C, D 螢光顯微鏡下觀察細胞內AVO的形成。結果為平均值±SD (n=3)。 *p< 0.05; ***p <與未處理的細胞相比為 0.001。 ###p <與CoQ0 處理的細胞相比,0.001 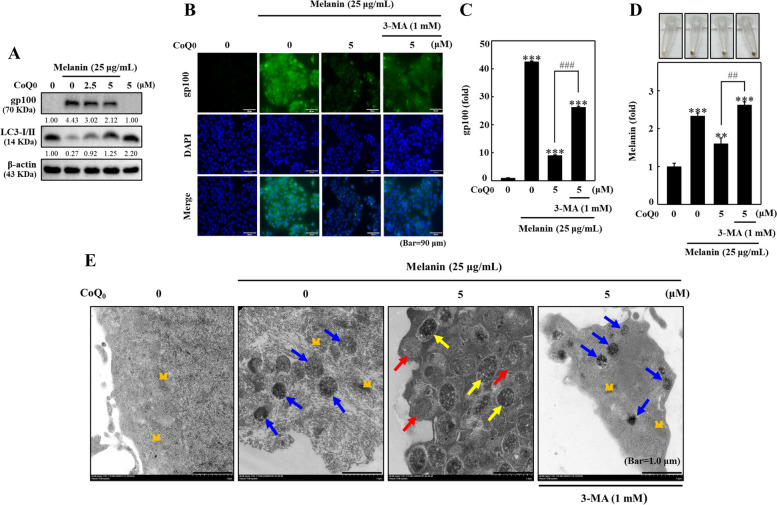
圖12
12 < / p>
CoQ 0 抑制黑素體相關...
圖12
CoQ 0 抑制黑素體相關gp100 表達,並透過誘導...觸發黑色素降解
圖12 CoQ0抑制黑素體相關的 gp100 表達,並透過誘導黑色素餵食的 HaCaT 細胞自噬作用來觸發黑色素降解。用或不用 3-MA(1 mM,1 小時)預處理黑色素處理的 HaCaT 細胞,然後用 CoQ0(0-5 μM,24 或 72 小時)處理。 A 使用免疫印跡法測定 gp100 和 LC3B 表現(24 h)。 B、C 以免疫螢光染色評估 gp100 表現(24 小時)。 D 使用方法部分中描述的程序估計細胞內黑色素水平(72 小時)。結果為平均值±SD (n=3)。 **p < 0.01; ***p <與未處理的細胞相比為 0.001。 ##p< 0.01; ###p <與 CoQ0 處理的細胞相比為 0.001。 E TEM 來分析 CoQ0 促進黑色素體吞噬自噬體和自溶小體的形成。黑色素處理的 HaCaT 細胞用或不用 3-MA(1 mM,1 小時)預處理,然後用 CoQ0(0 或 5 μM,24 小時)預處理。 M = 粒線體。藍色、黃色和紅色箭頭分別表示黑色素/黑色素體、含有黑色素/黑色素體的自噬體和自溶小體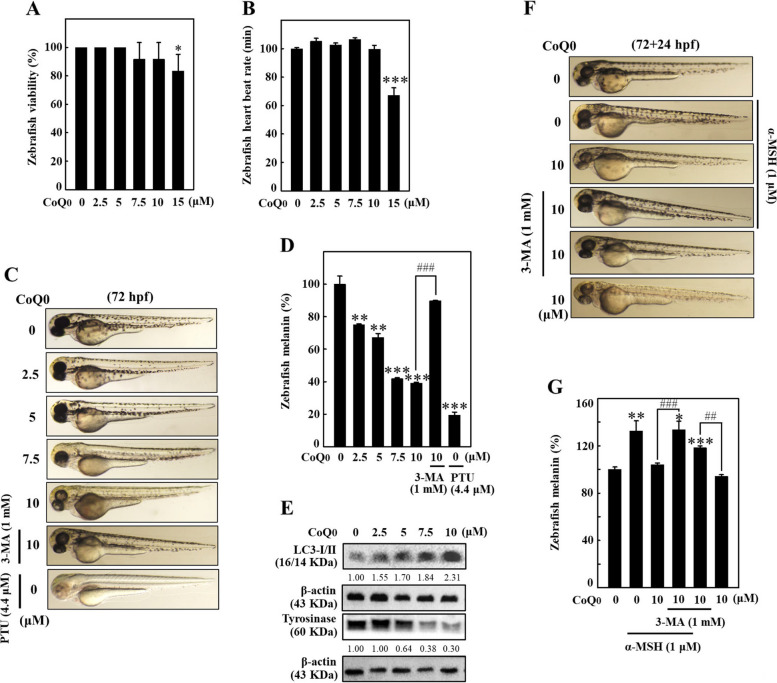
圖13
CoQ 0 觸發抗黑色素生成與…
圖13
CoQ 0 觸發抗黑色素生成和黑色素斑馬魚胚胎的退化。 A-E 斑馬魚胚胎,…
圖 13 CoQ0 觸發斑馬魚胚胎中的抗黑色素生成和黑色素降解。 A-E 斑馬魚胚胎,9 hpf,用或不用 3-MA (1 mM) 處理,然後用載體 (0.1% DMSO) 或 CoQ0 (0-15 μM) 處理,直至 72 hpf。 A、B 使用立體顯微鏡測量斑馬魚的活力(%)和心率(次/分鐘)。 C、D CoQ0 抑制斑馬魚的黑色素生成。 PTU (4.4 μM) 作為陽性對照。 E 處理結束時,提取蛋白質,並進行免疫印跡測定以測量LC3-II和酪胺酸酶的表達。 F、G CoQ0 引發斑馬魚黑色素降解。 72 hpf 時的斑馬魚用或不用 3-MA (1 mM) 處理,然後用 CoQ0(0 或 10 μM)處理 24 小時(72+24 hpf),用或不用 α-MSH (1 μM) 刺激。依照方法部分所述測量斑馬魚(顯示側視圖)內源性身體色素沉著(黑色素水平)的變化。結果為平均值±SD (n=3)。 *p< 0.05; **p < 0.01; ***p <與對照斑馬魚胚胎相比為 0.001。 ##p < 0.01; ###p <與CoQ0 處理的斑馬魚相比,為0.001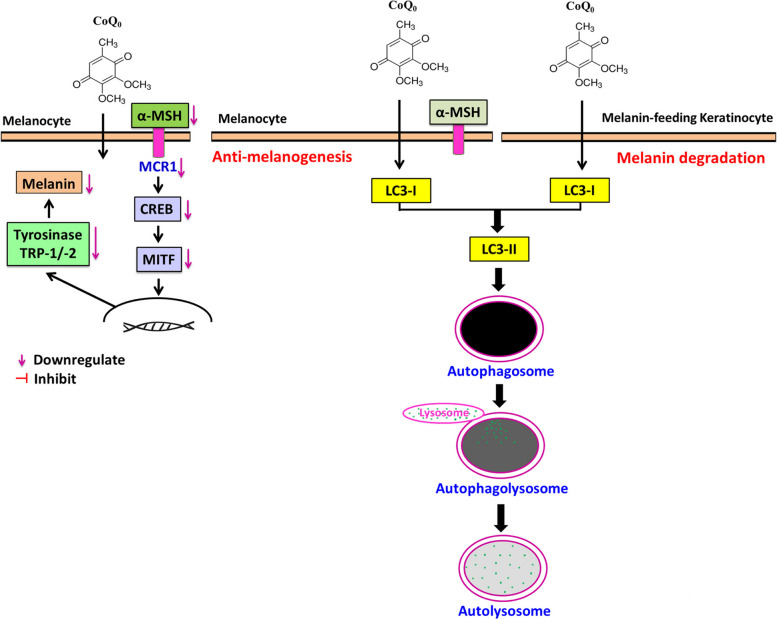
圖14
CoQ 0 的脫色活性…
圖14
CoQ 0 透過抗黑素生成和自噬誘導黑色素降解實現脫色活性…
圖14 脫色CoQ0 在黑色素瘤 (B16F10) 和黑色素餵食角質形成細胞 (HaCaT) 細胞中透過自噬誘導抗黑色素生成和黑色素降解的活性 所有圖 (14)