EK100 和 Antrodin C 透過促進小膠質細胞和血管周圍清除途徑改善 APP/PS1 基因轉殖小鼠的腦澱粉樣蛋白病理學
摘要
阿茲海默症(AD)的特徵是β-澱粉樣勝肽(Aβ)的沉積。目前還沒有藥物可以成功治療這種疾病。本研究首先探討了牛樟芝中分離的七種成分在BV2細胞中的抗發炎活性,並選擇EK100和antrodin C進行體內研究。 APPswe/PS1dE9 小鼠接受 EK100 和 antrodin C 治療 1 個月,透過築巢行為、免疫組織化學和免疫印跡評估這些試劑對 AD 樣病理學的影響。麥角固醇和布洛芬作為對照。 EK100和antrodin C改善了小鼠的築巢行為,減少了澱粉樣蛋白斑塊的數量和負擔,減少了膠質細胞的活化,促進了小鼠大腦中Aβ的血管周圍沉積。 EK100和antrodin C在活化星狀細胞、調節小膠質細胞形態、促進斑塊相關小膠質細胞表達氧化酶方面有顯著差異。相較之下,布洛芬和麥角固醇的作用相對較小。此外,EK100 顯著改善 APPswe/PS1dE9 小鼠的海馬神經新生。我們的數據表明,EK100和antrodin C透過減少澱粉樣蛋白沉積並透過小膠質細胞和血管周圍清除促進APPswe/PS1dE9小鼠的築巢行為來減輕AD的病理,這表明EK100和antrodin C具有用於AD治療的潛力。 /> < p> 圖 1
化合物的結構...
圖 1
本研究所使用的化合物的結構。 ( A )…
圖 1 本研究所使用的化合物的結構。 (A) EK100 (Ergosta-7,9(11),22-trien-3β-ol)、麥角固醇 (Ergosta-5,7,22-trien-3β-ol)、 Anticin K (3α,4β,7β-trihygroxy-4α-methylergosta-8,24(28)-dien-11-on-26-oic 酸)、脫氫依布酸((2R)-2-[(3S,5R, 10S) ,13R,14R,17R)-3-羥基-4,4,10,13,14-五甲基-2,3,5,6,12,15,16,17-八氫-1H-環戊[a]菲- 17-基]-6-甲基-5-亞甲基庚酸)、依布酸((2R)-2-[(3S,5R,10S,13R,14R,17R)- 3-羥基-4,4,10,13 ,14-五甲基-2,3,5,6,7,11,12,15,16,17-十氫-1H-環戊[a]菲- 17-基]-6-甲基-5-亞甲基庚酸),脫氫磺酸((2R)-2-[(3S,5R,10S,13R,14R,15S,17R)-3,15 -二羥基-4,4,10, 13,14-五甲基-2,3,5, 6,11,12,15,16,17-十氫-1H-環戊[a]菲-17-基]-6-甲基-5-亞甲基庚酸)和硫酸((2R)-2-[(3S ,5R,10S,13R,14R,15S,17R)-3,15-二羥基-4 ,4,10,13,14-五甲基-2,3,5,6,7, 11,12,15,16, 17-十氫-1H-環戊[a]菲-17-基]- 6-甲基-5-亞甲基庚酸)。 (B) antrodin C(3-異丁基-4-[4-(3-甲基-2-丁烯氧基)苯基]-1H-吡咯-1-醇-2 ,5-二酮的結構)和布洛芬(異丁基苯基丙酸)。紅色方塊表示生物活性化合物,藍色方塊表示對照化合物。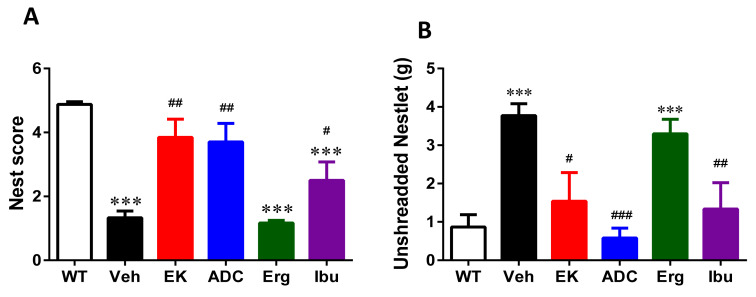
圖2
< p> EK100、antrodin C 和布洛芬…圖2
EK100、antrodin C 和布洛芬改善APP/PS1 小鼠的築巢行為缺陷。 APP/PS1…
圖 2 EK100、antrodin C 和布洛芬改善 APP/PS1 小鼠的築巢行為缺陷。 APP/PS1 基因轉殖小鼠口服賦形劑(Veh) 或EK100 (EK)、安樂素C (ADC)、麥角固醇(Erg) 和布洛芬(Ibu)(30 mg·kg−1·day−1,n = 6每個)。築巢任務在給藥後 30 天進行。也比較了野生型 (WT) 小鼠 (n = 6) 的圖像。長條圖顯示嵌套任務的嵌套分數 (A) 和嵌套任務中未粉碎的 Nestlet (B) 的結果。結果為平均值±S.E.M。 WT組與其他組之間的顯著差異以***表示,p<1。 0.001。 Veh組和試劑處理組之間的顯著差異由#表示,p<1。 0.05; ##,p< 0.01; ###,p < 0.001。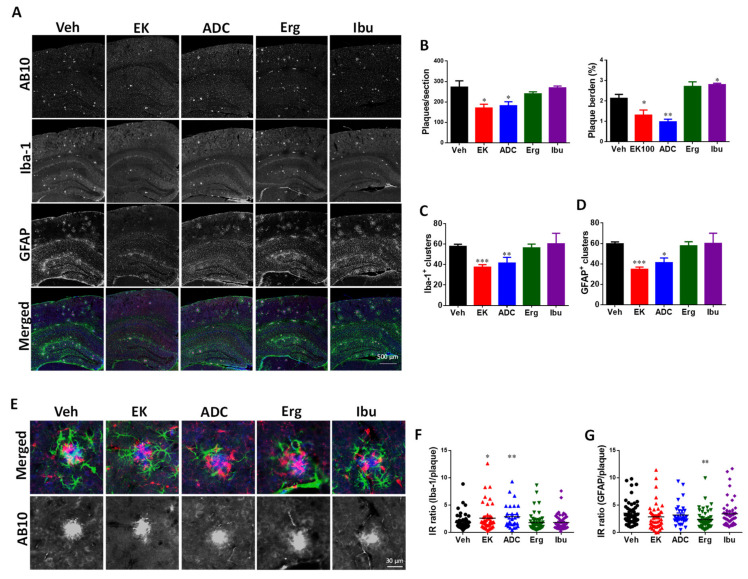
圖3
< p> EK100 和antrodin C 減少...圖3
EK100 和antrodin C 減少澱粉樣蛋白斑塊負荷、神經膠質簇的數量,並且... < /p> 圖3 EK100 和antrodin C減少 APP/PS1 小鼠中澱粉樣蛋白斑塊負荷、神經膠質簇數量以及斑塊相關神經膠質活化。 APP/PS1 基因轉殖小鼠口服載體(Veh) 或EK100 (EK)、antrodin C (ADC)、麥角固醇(Erg) 和布洛芬(Ibu)(30 mg·kg−1·day−1,每個n = 6) 1 個月,然後分別以 AB10、Iba-1 和 GFAP 抗體對澱粉樣蛋白斑、小膠質細胞和星狀細胞進行免疫染色。 (A)。顯示了 AB10(合併圖中的藍色)、Iba-1(合併圖中的紅色)和 GFAP(合併圖中的綠色)的代表性螢光影像。比例尺:500 μm。 (B–D),AB10 染色噬菌斑的數量和負荷 (B) 以及 Iba-1+ 簇的數量 (<計算並顯示大腦半球中的b>C) 和GFAP+ 簇(D)。結果為平均值±S.E.M。 Veh組和試劑處理組之間的顯著差異以*表示,p<1。 0.05; **,p< 0.01; ***,p< 0.001。 (E)。顯示了用 AB10(合併圖中的藍色)、Iba-1(合併圖中的紅色)和 GFAP(合併圖中的綠色)抗體免疫染色的神經膠質簇的代表性螢光圖像。比例尺:30 μm。 (F,G)。計算並顯示 Iba-1 與 AB10 (F) 和 GFAP 與 AB10 (G) 的免疫強度 (IR) 比值。結果為平均值±S.E.M。 Veh組和試劑處理組之間的顯著差異以*表示,p<1。 0.05; **,p< 0.01。 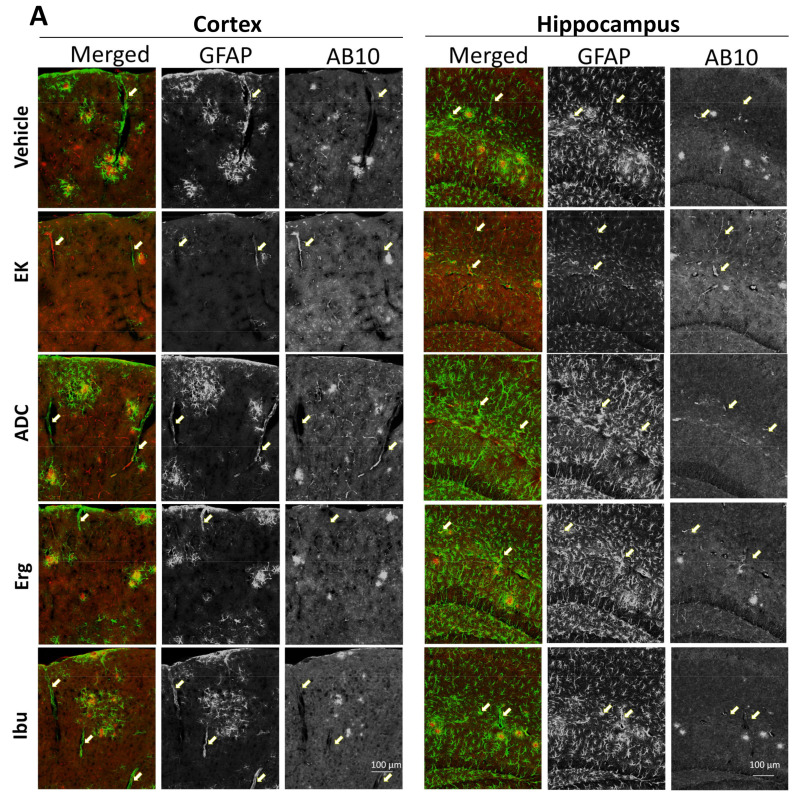
圖4
< p> EK100 和antrodin C 增加…圖4
EK100 和antrodin C 增加APP/PS1 小鼠血管周圍Aβ 沉積。 APP/PS1 轉基因…
圖 4 EK100 和 antrodin C 增加 APP/PS1 小鼠血管周圍 Aβ 沉積。 APP/PS1 基因轉殖小鼠口服載體(Veh) 或EK100 (EK)、antrodin C (ADC)、麥角固醇(Erg) 和布洛芬(Ibu)(30 mg·kg−1·day−1,每個n = 6) 1個月,然後星狀細胞和小膠質細胞分別進行GFAP和Iba-1抗體的免疫染色。 (A) 顯示了皮質和海馬中 GFAP 和 AB10 的代表性免疫染色圖像。比例尺:100 μm。箭頭表示代表性的血管周圍區域。 (B)。透過 MetaMorph 影像分析軟體計算並顯示血管周圍 Aβ 沉積佔總 Aβ 沉積的百分比。結果為平均值±S.E.M。 Veh組與其他組之間的顯著差異以*表示,p<1。 0.05; **,p< 0.01。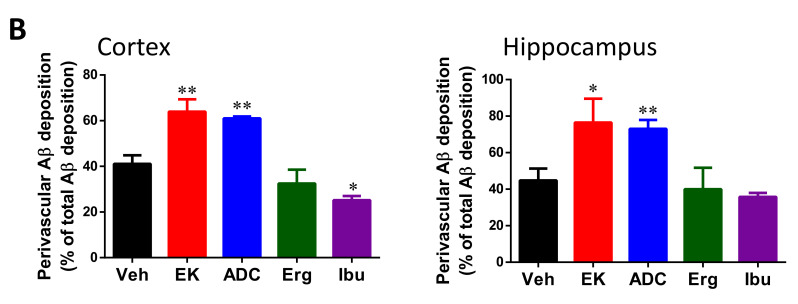
圖4
< p> EK100 和antrodin C 增加…圖4
EK100 和antrodin C 增加APP/PS1 小鼠血管周圍Aβ 沉積。 APP/PS1 轉基因…
圖 4 EK100 和 antrodin C 增加 APP/PS1 小鼠血管周圍 Aβ 沉積。 APP/PS1 基因轉殖小鼠口服載體(Veh) 或EK100 (EK)、antrodin C (ADC)、麥角固醇(Erg) 和布洛芬(Ibu)(30 mg·kg−1·day−1,每個n = 6) 1個月,然後星狀細胞和小膠質細胞分別進行GFAP和Iba-1抗體的免疫染色。 (A) 顯示了皮質和海馬中 GFAP 和 AB10 的代表性免疫染色圖像。比例尺:100 μm。箭頭表示代表性的血管周圍區域。 (B)。透過 MetaMorph 影像分析軟體計算並顯示血管周圍 Aβ 沉積佔總 Aβ 沉積的百分比。結果為平均值±S.E.M。 Veh組與其他組之間的顯著差異以*表示,p<1。 0.05; **,p< 0.01。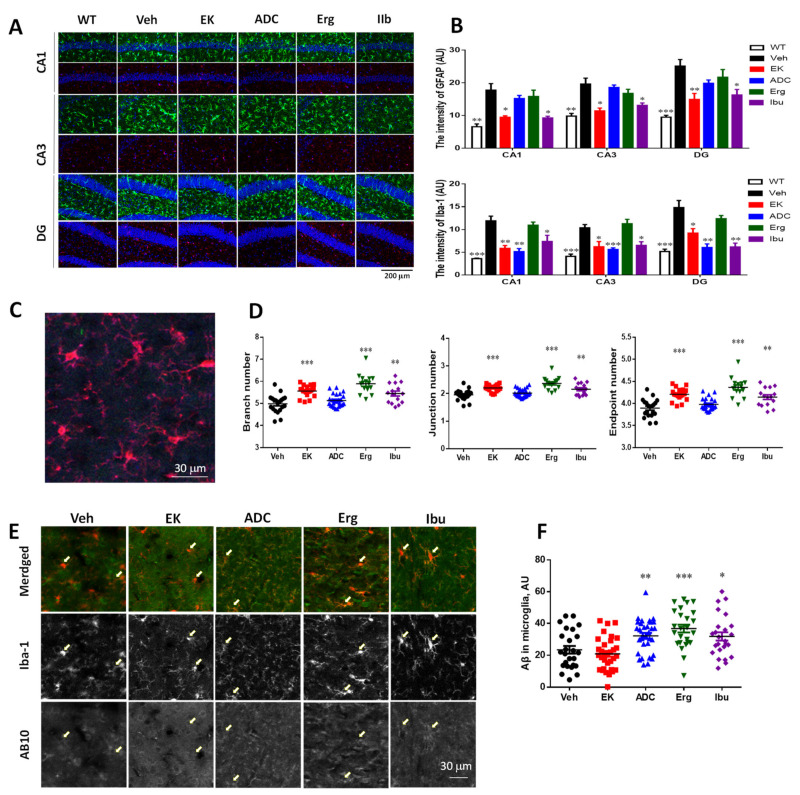
圖5
< p> EK100 減少非簇狀膠質細胞活化…圖5
EK100 減少APP/PS1 小鼠非簇狀膠質細胞活化。 APP/PS1 基因轉殖小鼠口服給藥...
圖 5 EK100 減少 APP/PS1 小鼠的非簇狀膠質細胞活化。 APP/PS1 基因轉殖小鼠口服載體(Veh) 或EK100 (EK)、antrodin C (ADC)、麥角固醇(Erg) 和布洛芬(Ibu)(30 mg·kg−1·day−1,每個n = 6) 1個月,然後星狀細胞和小膠質細胞分別以GFAP和Iba-1抗體進行免疫染色。 (A,B) GFAP(綠色)和 Iba-1(紅色)的代表性免疫染色圖像,與 Cornu Amonis (CA)1、CA3、齒狀大師(DG)如(A)所示。也比較了野生型 (WT) 小鼠 (n = 6) 的圖像。比例尺:200 μm。透過MetaMorph影像分析軟體計算CA1、CA3和DG中GFAP和Iba-1的水平,並顯示在(B)中。結果為平均值±S.E.M。 Veh組與其他組之間的顯著差異以*表示,p<1。 0.05; **,p< 0.01; ***,p< 0.001。 (C、D)。 (C) 中顯示了與牙菌斑無關的 Iba-1(紅色)的代表性圖像。透過FIJI ImageJ軟體計算Iba-1免疫染色小膠質細胞的分支數、連接數和終點數。結果為平均值±S.E.M。 Veh組和其他組之間的顯著差異由**表示,p<1。 0.01; ***,p< 0.001。 (E,F)。 (E) 中顯示了與皮質中的斑塊無關的 Iba-1(紅色)和 Aβ 的代表性免疫染色圖像。箭頭表示代表性的小膠質細胞。透過MetaMorph影像分析軟體計算小膠質細胞內的Aβ,如圖(F)所示。結果為平均值±S.E.M。 Veh組與其他組之間的顯著差異以*表示,p<1。 0.05; **,p< 0.01; ***,p< 0.001。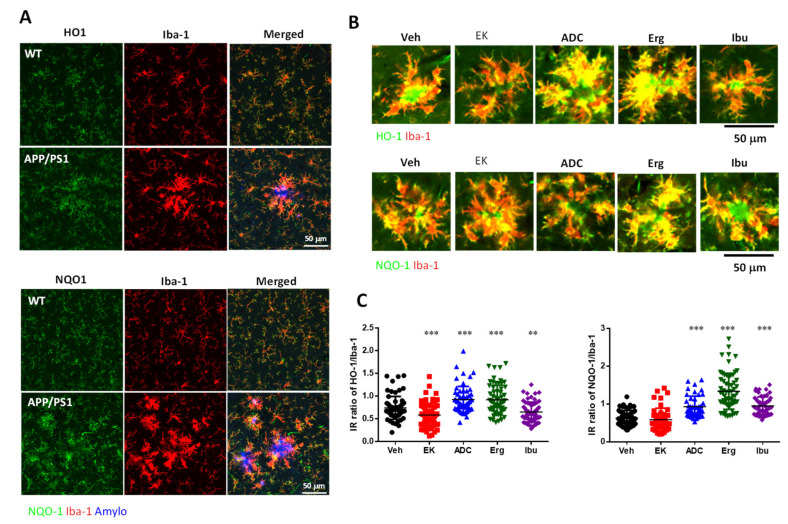
圖6
< p> Antrodin C,但不是EK100,…圖6
Antrodin C,但不是EK100,在APP/PS1 小鼠中促進HO-1。 ( A –…
圖6 Antrodin C(而非EK100)促進APP/PS1 小鼠中的HO-1。(A–E ) APP/PS1 基因轉殖小鼠口服載體(Veh) 或EK100 (EK)、antrodin C (ADC)、麥角固醇(Erg) 和布洛芬(Ibu)(各30 mg·kg−1·day− 1)。代表性圖像顯示在(A) 澱粉樣蛋白斑塊用 Amylo-Glo(藍色)染色:HO-1(上圖綠色)和 NQO1(下圖綠色)的代表性圖像。 APP/PS1 基因轉殖小鼠的Iba-1+ 小膠質細胞(紅色)中HO-1/Iba-1 和NQO-1/Iba-1 的免疫強度(IR) 比率顯示在(B) 中。 b>) 中。 Nrf2 和 HO-1 與 β-肌動蛋白的比率以 WT 組的百分比表示 (E)。 (F,G) APP/PS1 基因轉殖小鼠口服載體(Veh) 或EK100 (EK) 和antrodin C (ADC)(30 mg·kg−1·day ) −1,每個 n = 6) 持續 1 個月。 WT小鼠和APP/PS1基因轉殖小鼠神經元中Nrf2(合併圖中的綠色)和AB10(合併中的紅色)的代表性圖像顯示在(F)中。使用 Hoechst 33258(藍色)進行細胞核染色。比例尺:20 μm。計算 Nrf2 和 AB10 的免疫強度 (IR) 並顯示在 (G) 中。結果為平均值±S.E.M。 Veh組與其他組之間的顯著差異以*表示,p<1。 0.05; **,p< 0.01; ***,p< 0.001。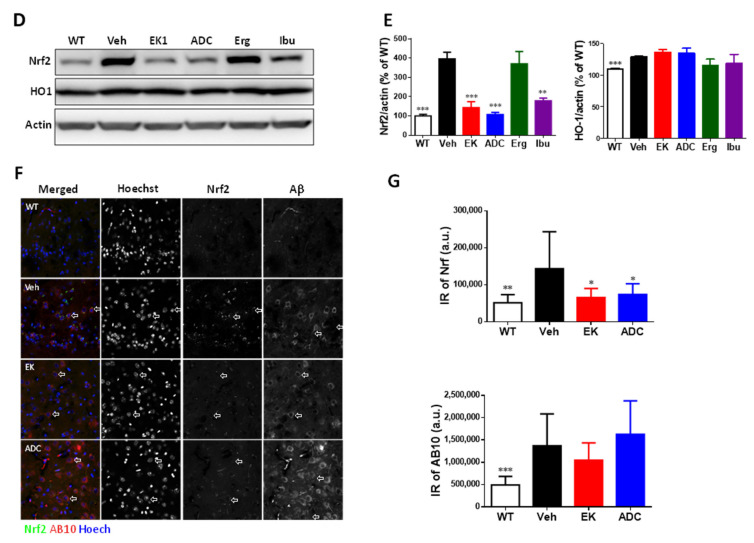
圖6
< p> Antrodin C,但不是EK100,…圖6
Antrodin C,但不是EK100,在APP/PS1 小鼠中促進HO-1。 ( A –…
圖6 Antrodin C(而非EK100)促進APP/PS1 小鼠中的HO-1。(A–E ) APP/PS1 基因轉殖小鼠口服載體(Veh) 或EK100 (EK)、antrodin C (ADC)、麥角固醇(Erg) 和布洛芬(Ibu)(各30 mg·kg−1·day− 1)。代表性圖像顯示在(A) 澱粉樣蛋白斑塊用 Amylo-Glo(藍色)染色:HO-1(上圖綠色)和 NQO1(下圖綠色)的代表性圖像。 APP/PS1 基因轉殖小鼠的Iba-1+ 小膠質細胞(紅色)中HO-1/Iba-1 和NQO-1/Iba-1 的免疫強度(IR) 比率顯示在(B) 中。 b>) 中。 Nrf2 和 HO-1 與 β-肌動蛋白的比率以 WT 組的百分比表示 (E)。 (F,G) APP/PS1 基因轉殖小鼠口服載體(Veh) 或EK100 (EK) 和antrodin C (ADC)(30 mg·kg−1·day ) −1,每個 n = 6) 持續 1 個月。 WT小鼠和APP/PS1基因轉殖小鼠神經元中Nrf2(合併圖中的綠色)和AB10(合併中的紅色)的代表性圖像顯示在(F)中。使用 Hoechst 33258(藍色)進行細胞核染色。比例尺:20 μm。計算 Nrf2 和 AB10 的免疫強度 (IR) 並顯示在 (G) 中。結果為平均值±S.E.M。 Veh組與其他組之間的顯著差異以*表示,p<1。 0.05; **,p< 0.01; ***,p< 0.001。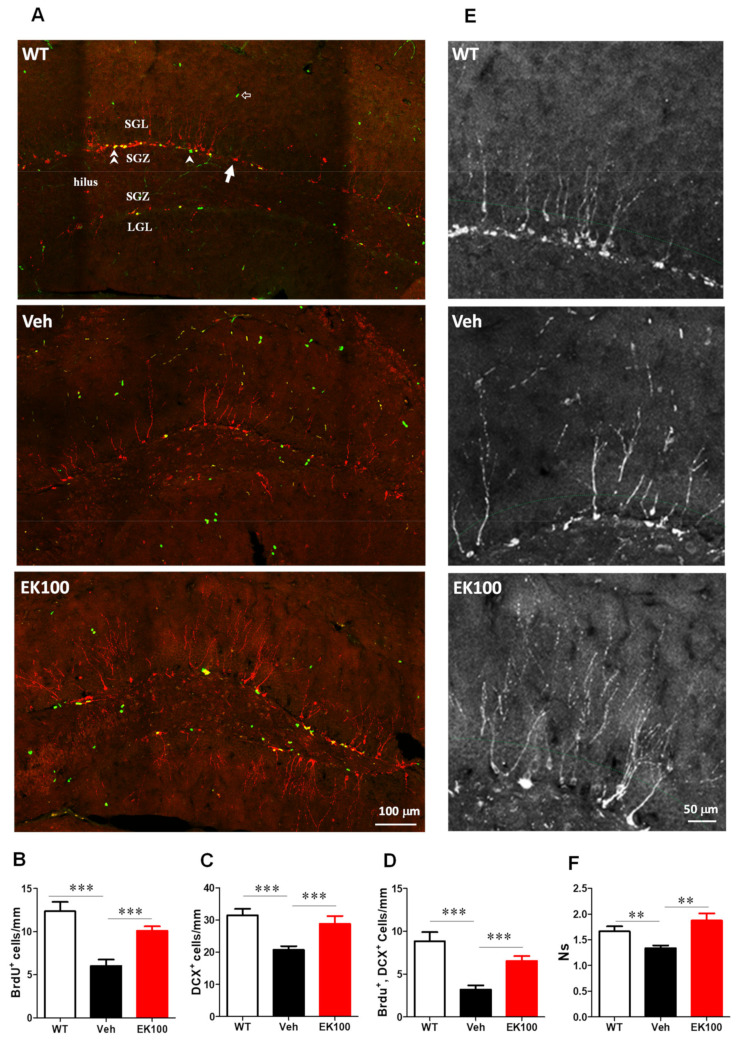
圖7
< p> EK100 促進…的海馬神經新生圖7
EK100 促進APP/PS1 小鼠的海馬神經新生。 APP/PS1基因轉殖小鼠口服...
圖7 EK100促進APP/PS1小鼠海馬神經新生。 APP/PS1 基因轉殖小鼠口服載體 (Veh) 或 EK100(30 mg·kg−1·day−1,各 n = 6)1 個月。野生型(WT)小鼠用作非基因改造對照。使用雙皮質素抗體(DCX,紅色)和 BrdU 抗體(綠色)進行免疫組織化學染色來檢測海馬神經新生。齒狀回的代表性圖像如(A)所示。箭頭表示DCX標記的新生神經元;箭頭表示增殖的2型神經祖細胞;雙箭頭表示增生後立即新生的神經元;空心箭頭表示神經祖細胞以外的增生細胞。 ML,分子層; UGL,上葉片顆粒細胞層; SGZ,亞顆粒區; LGL,下部葉片顆粒細胞層。比例尺:100 μm。 B–D 面板顯示 BrdU 陽性細胞(BrdU+、B)的數量/mm SGZ; DCX陽性細胞(DCX+,C)和雙標記細胞(BrdU+,DCX+,D)。 (E) 顯示了上葉片齒狀回區域的代表性免疫染色影像。比例尺:50 μm。 DCX+ 細胞的次級樹突沿著顆粒細胞層的中間(GCL,綠色虛線)進行計數。 (F) 以層流定量分析樹突複雜度。顯示了DCX+細胞的次級樹突的分支比率。 DCX+ 細胞的樹突沿著 GCL 的中部計數。結果為平均值±S.E.M。 Veh 組和其他組之間有顯著差異。 **,p< 0.01; ***,p< 0.001。 所有人物 (9)